UC San Diegoのグループは、核内クロマチンタンパク質であるHigh mobility group box 1(HMGB1)が敗血症で細胞外に放出され、好中球の受容体に結合し炎症を加速する際に、血液のpH、血中のZn濃度、そしてシアル酸修飾を受けた血中タンパク質の存在が大きくかかわっていることを示しました。
https://www.pnas.org/content/118/10/e2018090118
従来より、HMGB1は、正常組織では細胞核内でDNAと結合することによりクロマチン構造を制御して遺伝子発現を調節するシャペロンタンパク質として機能する一方、壊死組織では細胞外に放出されると自然免疫を活性化して好中球らの壊死組織への集積を誘導し、壊死組織除去を促進させることが知られていました。
http://www.med.osaka-u.ac.jp/introduction/research/endowed/therapy
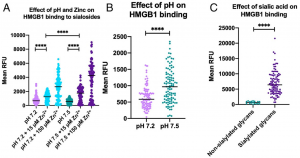
HMGB1の好中球への結合は、血液のpH、および血中のZn濃度によって、大きく阻害されることが新たに示されるとともに、HMGB1が、シアル酸認識レクチンとして、血中のシアロ糖タンパク質と結合することで、好中球への結合が阻害されることが示されました。
血液のpHは、健常時には、7.35~7.45に厳密に制御されています。しかし、敗血症になるとpHが、7.3以下に下がります。また、血中のZn濃度も数µMにまで低下します。健常な状態では、HMGB1は、細胞外に放出されても血中のシアロ糖タンパク質に結合することで好中球への結合が阻害され炎症反応を誘発しません。しかし、血中のpHとZn濃度が下がると、シアロ糖タンパク質が阻害剤として機能しなくなり、好中球に結合して炎症を加速します。とすると、COVID-19で多臓器不全を起こしている状態において、pHと血中Zn濃度に着目し、HMGB1を阻害する治療法も有効なのかも知れません。