A group from Section of Infectious Diseases, Department of Internal Medicine, Yale University School of Medicine, New Haven, CT, USAらのグループは、レプトスピラの病原性改変 (VM)タンパク質は、タンデムN-末端リシンB-鎖様β-トレフォイルドメインを含む新規R型レクチンであると報告しています。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9002632/
いわゆる病原性改変(VM)タンパク質は、レプトスピラ症の病因に関係しており。レプトスピラ症は、世界的に重要な人獣共通感染症であります。
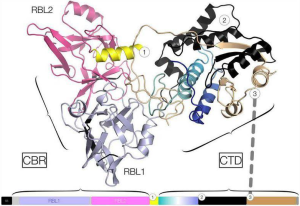
VMタンパク質(PF07598)の遺伝子相同性検索から、タンデムリシンB-鎖様レクチンサブドメインがそのタンパク質のN-末端領域で同定されました。リシンB鎖、レプトスピラVMタンパク質は、例えばモデルタンパク質として、末端ガラクトースおよびアシアロフェツインなどのN-アセチルガラクトサミン残基に結合する可能性があります。
実際、大腸菌で発現した組換えVMタンパク質はアシアロフェツインに結合し、競合アシアロフェツイン結合アッセイによって決定されたリシンB-鎖と同様の糖鎖結合特異性を示すことが実験的に確認されました。
レプトスピラVMタンパク質は、末端ガラクトシル残基に特異的なN末端R型レクチンドメインを介してHeLa細胞に結合し、HeLa細胞によって迅速に内在化されます。この細胞表面の結合と内在化は迅速であり、アプライ後30分以内に発生し、アクチン解重合、カスパーゼ3活性化、核断片化、最終的にはアポトーシスによる細胞死など、HeLa細胞に多面的効果を誘発することが示されました。
細胞死のメカニズムのひとつは、VMタンパク質の核局在化後に発生するゲノムDNA分解であります。精製されたHeLa細胞ゲノムDNA、およびスーパーコイル化および線形化されたレプトスピラ・プラスミドDNAを使用したin vitro実験では、VMタンパク質がDNase活性を持っていることが示されました。また、VMタンパク質のC-末端ドメイン(CTD)は、ウシのDNaseIと同一の保存された活性部位残基を持っていることも分かりました。
つまり、細胞表面への結合、内在化、核転座、およびDNase機能の組み合わせは、VMタンパク質が細菌のABドメインを含む毒素パラダイムの新しい形態として進化したことを示しているようです。