有機農場と従来型の無機質肥料を多用する農場でのニンジンの根圏バクテリアや真菌の違い
University of Life Sciences in Lublin, Lublin, Polandらのグループは、有機農場と従来型の農場での根圏細菌の違いについて報告しています。
https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0256969
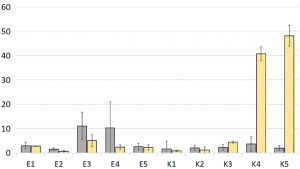
堆肥や肥料などの天然肥料が使用された有機農場(下図でE1〜E5、平均 pH=7.08、平均土壌水分量=20.12%)と、主にミネラル肥料が使用されていた従来型の農場(下図でK1〜K5、平均 pH=6.13、K4とK5が一番酸性度が高い、平均土壌水分量=14.46%、K5が一番水分量が低い)を比較対象とし、植物として人参を使用して、その根圏における代表的な違いを議論しています。
土壌バクテリアと真菌について、
有機農場からのすべてのサンプルには、真菌よりも多くのバクテリアが含まれていた。
無機質肥料を大量に施用している従来型の農場は酸性度が高い傾向にあり、酸性度が高いほど(K3<K4~K5)バクテリアの存在量を遥かに超える真菌が見つかった。
中性の土壌pHがバクテリアの成長に有利であった。
菌類は酸性土壌で優勢であった。
土壌酵素について、
L-グルタミナーゼ、β-グルコシダーゼが有機農場で高い傾向にあった。
酸性ホスファターゼが従来型の農場で高い傾向があった。