Vir Biotechnology, San Francisco, USAらのグループは、C-型レクチン (DC-SIGN and L-SIGN) や SIGLEC1 は、SARS-CoV-2の直接的な感染受容体ではなく、付着受容体であると述べています。
https://www.nature.com/articles/s41586-021-03925-1
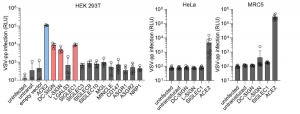
実験には、HEK293T 細胞が使用され、ACE2および13種類のレクチン(DC-SIGN、L-SIGN、LGALS3、SIGLEC1、SIGLEC3、SIGLEC9、SIGLEC10、MGL、MINCLE、CD147、ASGR1、ASGR2、NRP1)のそれぞれをコーディングしたベクターを導入して、人為的にこれらの受容体を発現させました。これらを導入していない生の HEK293T 細胞においては、SARS-CoV-2疑ウイルスは殆ど感染せず、しかしながら、ACE2を過剰発現させると、疑ウイルスの感染がドラスティックに増加しました。
C-型レクチンであるDC-SIGN、L-SIGNや、SIGLEC1でも大幅な感染増加がHEK293T細胞で見られました。しかしながら、感染受容体として報告されているNRP-1 も CD147 もこの実験条件下では、SARS-CoV-2の感染に関しては如何なる影響も与えませんでした。SIGLEC1 の阻害抗体をアプライすると、SARS-CoV-2疑ウイルスの感染がドラスティックに減少し、SARS-CoV-2の感染共受容体としてSIGLEC1が機能していることが示唆されました。これら各種受容体は、細胞種毎に発現レベルが異なっており、SIGLEC1は、マクロファージ、樹状細胞、単球らに高発現しています。このことから、現実的には、SARS-CoV-2が付着したこれら細胞からターゲット細胞へのSARS-CoV-2のトランス感染の可能性が高いと推測されました。また、ACE2がほとんど発現していないHeLa細胞やMRC5細胞の場合には、DC-SIGN、L-SIGN、SIGLEC1をトランスフェクトしてもSARS-CoV-2の感染は増加しませんでした。 これらのことから、ACE2の発現レベルが低い細胞においては、レクチンを介した感染パスが存在し、SARS-CoV-2がこれらのレクチンと相互作用することによって、ACE2との相互作用が増強されるという付着受容体としての役割をこれらレクチンが果たしていると結論されました。
ブログ管理人は、しかしながら、この論文にはSARS-CoV-2の単球やマクロファージへのエンドサイトーシスや貪食を介した直接感染という視点が欠落していると思います。
ウイルス感染におけるキーとなるステップは、ウイルス遺伝子の宿主細胞の細胞質内への放出にあります。これを行うために、ウイルスは細胞膜上の特定の受容体(SARS-CoV-2の場合にはACE2)に結合し、引き続いて直接的に細胞膜と融合、あるいはまたエンドサイトーシスや貪食による取り込みに引き続いて細胞膜融合を行います。エンドサイトーシスや貪食には、抗体によって補足されたウイルス粒子を認識する単球やマクロファージのFcγ 受容体や、SRS-CoV-2 Spikeの異常糖鎖を認識するC-型レクチンや、はたまたトール様受容体が、絡んでくると思われます。