Johns Hopkins School of Medicine, Baltimore, USAらは、COVID-19の重症化において、補体代替経路の異常な活性化が深く関係していることを示唆しています。
https://pubmed.ncbi.nlm.nih.gov/34289657/
免疫の捕体経路には、現在以下の3種類があるとされています。古典捕体系路、補体代替経路、そしてレクチン経路であります。古典捕体系路は、抗体による活性化を必要とするのですが、補体代替経路の場合には、C3が直接細胞表面に結合し、B因子、D因子によって直接的に活性化されます。
COVID-19 の58人(内、32人は最小限の酸素吸入を必要としたもの、7名は最大限の酸素吸入を必要としたもの、17名は人口呼吸器を必要といたもの、2名は死亡)から得た血清が、補体を介した細胞死を招くことが補体機能アッセイで確認され、細胞表面において膜侵襲複合体(C5b-9)の結合を増加させました。41.2% 人工呼吸器を必要としたCOVID-19 患者の41.2%が、補体機能アッセイで陽性となりました(20%以上の細胞が死んだ場合を陽性)、最低限の酸素吸入しか必要としなかった患者では、その割合は僅かに6.3%に留まりました。そして更に、C5とD因子の阻害は、COVID-19患者の血清によって誘起される補体活性化の増幅を緩和し、血清中のBb因子の増加は、COVID-19患者の重症度と相関しており、補体代替経路の異常な活性化が重要な役割を果たしていることが示唆されました。
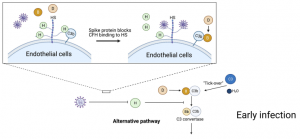
SARS-CoV-2 spike タンパク質が、補体因子Hのヘパリンへの結合を直接的にブロックしているようであり、それが細胞表面での補体調整不全に繋がっているようです。 つまり、感染初期の段階で、SARS-CoV-2 spike タンパク質が肺上皮細胞上のヘパラン硫酸と結合し、補体因子Hのヘパラン硫酸への結合を阻害することで、補体代替経路の調整不全が起きているようです。補体因子Hの結合が抑制されることで、因子Dによる因子Bの切断が増加し、Bbの生成が増加します。因子Bbは、C3bに結合し、C3転換酵素(C3bBb)が形成され、C3が切断され C5転換酵素(C4b2a3b or C3bBb3b)が形成されます。C5転換酵素は、C5を切断し、C5aとC5bを作り、C6-9と共に細胞膜侵襲複合体(C5b-9)を形成し、細胞を殺します。そしてこのことが過剰な炎症を招きます。このようにして、SARS-CoV-2 Spikeに起因する補体代替経路の調整不良が、COVID-19のCOVID-19の病理に深くかかわり、それが重要化のマーカーになるやも知れません。