Protein Engineering, Faculty of Biotechnology, University of Wroclaw, Wroclaw, Polandのグループは、galectin-1, -7, そして-8 がFGFR1の下流シグナリングとそのFGFR1のエンドサイトーシスを制御することが出来ると報告しています。
https://biosignaling.biomedcentral.com/articles/10.1186/s12964-024-01661-3
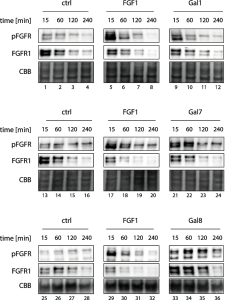
FGFR1のN-型糖鎖は、FGFR1の真のリガンド(FGF1)ではない細胞外ガレクチン (Gal-1、Gal-7、および Gal-8) によって認識され、これらのガレクチンが FGFR1 に結合すると、受容体が直接的に活性化され、下流のシグナル伝達カスケードが開始されます。活性化されたFGFR1のその後のエンドサイトーシスは、FGFR1シグナル伝達の下方制御のための主要な細胞機構として機能します。
FGF1とGal-1は両方ともFGFR1を直接活性化することが出来、FGFR1シグナル伝達の短く強力なパルスの後、クラスリン媒介エンドサイトーシスの誘導によりFGFR1シグナリングがシャットダウンされ、受容体のリソソーム分解が起こります。 Gal-7およびGal-8も受容体クラスタリング機構によってFGFR1を直接活性化することが出来ますが、FGFR1のエンドサイトーシスと分解を阻害することで、これらのガレクチンは FGFR1 シグナル伝達を長期に維持することができます。