Department of Nephropathology, University Hospital Erlangen, Friedrich-Alexander-University (FAU) Erlangen-Nürnberg, Erlangen, Germanyらのグループは、補体の活性化がCOVID-19における重症化に補体の活性化が大きく係わっていると報告しています。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8884149/
SARS-CoV-2による炎症性サイトカインの過剰産生に関与する可能性のある1つの経路は、補体系の活性化です。自然免疫系に属するこのシステムは、病原体や損傷した細胞が食細胞に取り込まれたり、白血球を引き付けて活性化したり、膜侵襲複合体(MAC)を介して細菌や細胞を直接溶解したりすることにより、感染に対する防御の重要な要素として機能します。
補体経路については、古典的経路、レクチン経路、および代替経路の3つの異なる経路が知られています。
古典的経路は、免疫複合体(抗原-IgMおよび抗原-IgG複合体)およびC1qに結合する他の多くの自己および非自己分子によって活性化され、コンフォメーション変化を引き起こし、セリンプロテアーゼであるC1sおよびC1rを活性化します。
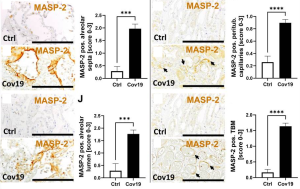
レクチン経路は、血中を循環するレクチン(マンナン結合レクチンやフィコリンなどのコレクチン)によって活性化され、病原体関連分子パターン(PAMP)と呼ばれる微生物表面の特異的な糖鎖パターンを認識し、MAPS-1およびMAPS-2を活性化し、C4をC4aおよびC4bに切断します。
代替経路は常に低レベルでアクティブであり、C3の自発的な加水分解によって開始されます。加水分解されたC3は、セリンプロテアーゼ因子D(CFD)の基質として作用する因子B(CFB)に結合し、C3コンバターゼを形成します。
最終的に、3つの補体経路すべてがC3コンバターゼの活性化につながり、C3をC3aとC3bに切断し、同じ経路を辿ってMACの形成を引き起こします。
この研究では、COVID-19で死亡したヒトと、非COVID-19で死亡したヒトとの検死サンプル(肺、腎臓)との比較研究を通じて、重度のCOVID-患者の肺と腎臓の両方でレクチン経路が活性化されたされていることが示されました。 レクチン経路の活性化は、C4bの分解物であるC4dがMASP-2と同じ局在性を示すことによって確認されました。このようにして、補体の活性化がCOVID-19の全身性悪化に関与している可能性があることが強く示唆されました。